Por Cristian García Martínez. Técnico de GanaSalud.
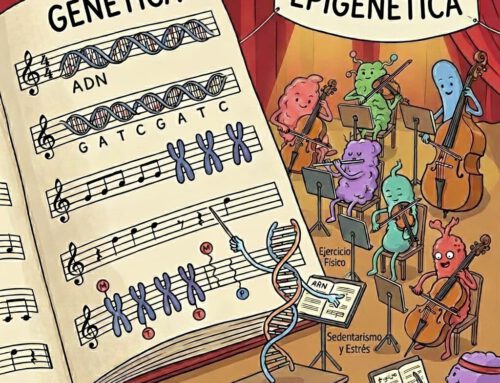
Durante años nos enseñaron que nuestro destino biológico estaba escrito en los genes, como si el ADN fuera un guión cerrado e inmutable.
Hoy sabemos que esa visión era incompleta. El ADN es el libro de instrucciones, sí, pero no se lee siempre igual. Y uno de los grandes editores de ese libro vive dentro de nosotros: la microbiota intestinal.
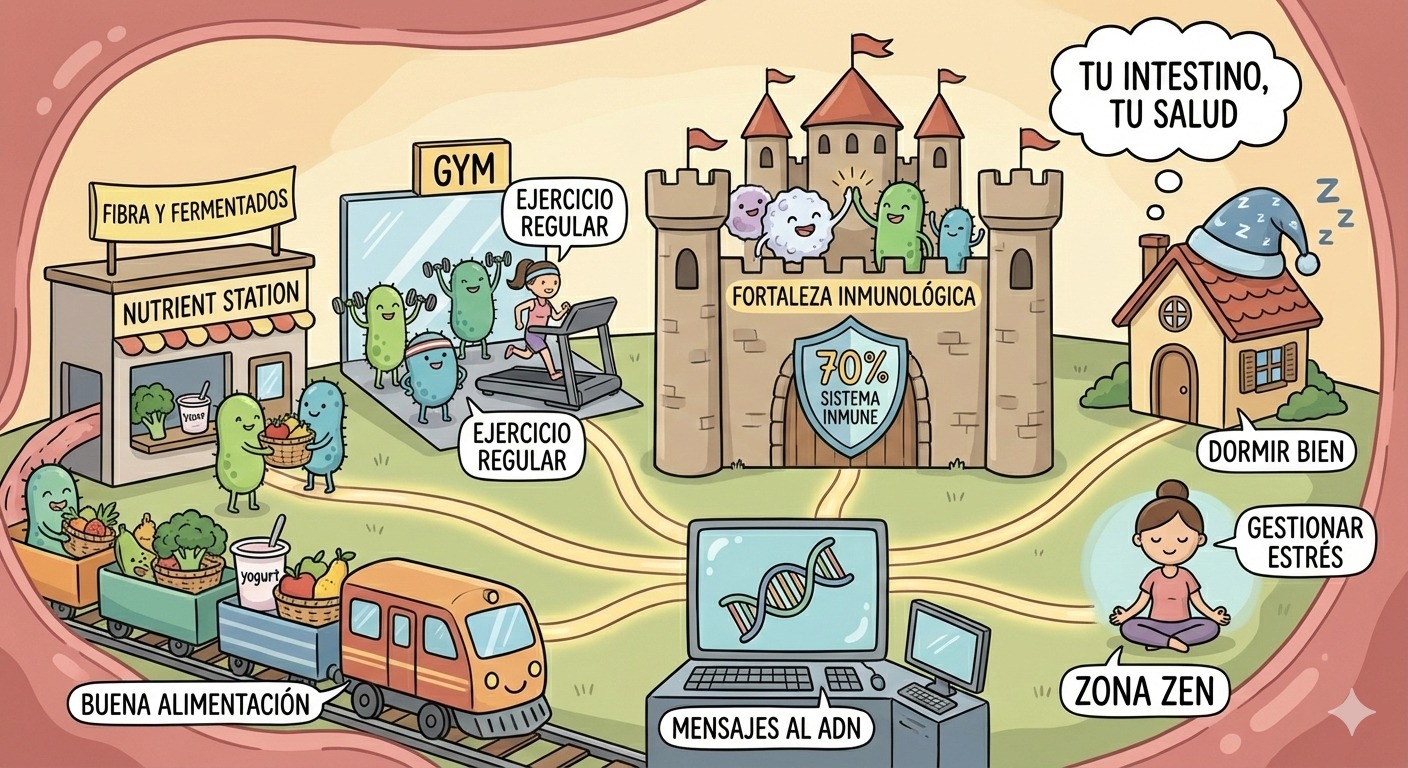
En el interior del intestino habitan billones de microorganismos que conviven con nuestras células en una relación íntima, constante y silenciosa. No son invasores ni simples pasajeros. Forman una comunidad viva que pesa alrededor de kilo y medio y cuya información genética supera con creces a la del genoma humano. Por eso se habla de ella como de un “segundo genoma”, uno que no se hereda al nacer, sino que se construye día a día con lo que comemos, cómo dormimos, cómo nos movemos y cómo gestionamos el estrés.
La clave no es que estas bacterias cambien nuestro ADN, sino que influyen en cómo se expresa. Ahí entra en juego la epigenética.
Epigenética: los interruptores que encienden y apagan tus genes
Como ya mencioné en otros artículos, la epigenética estudia los mecanismos que regulan qué genes se activan y cuáles permanecen silenciados, sin alterar la secuencia del ADN. Es como una casa con todas las luces instaladas: no siempre están todas encendidas, y no depende del cableado, sino de los interruptores.
Lo importante es que estos interruptores son sensibles al entorno. Nutrición, actividad física y ejercicio físico, inflamación crónica, tóxicos ambientales y, de forma muy especial, la microbiota intestinal influyen directamente sobre ellos.
Aquí es donde ambas piezas encajan.
La microbiota como intermediaria entre el estilo de vida y los genes
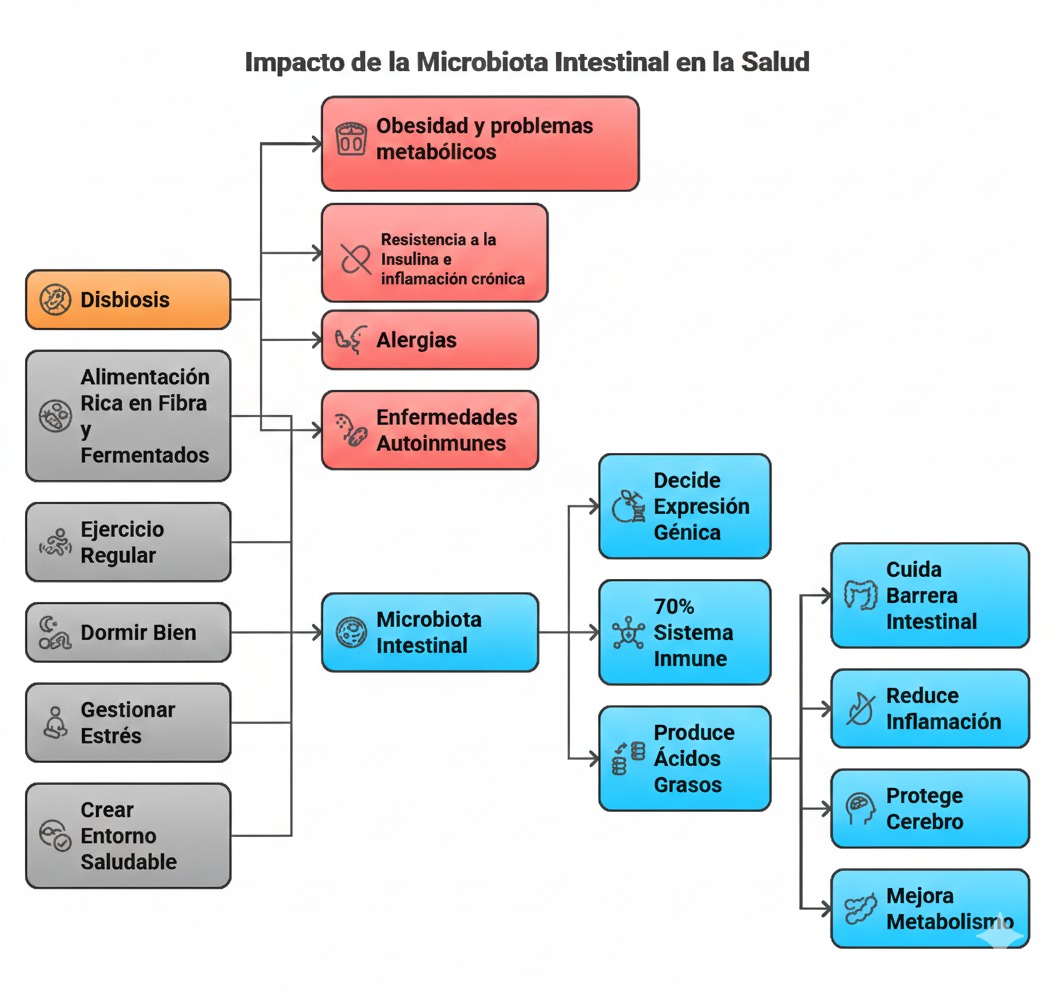
La microbiota no actúa de forma abstracta. Produce metabolitos concretos que tienen efectos medibles sobre nuestras células. Entre los más relevantes se encuentran los ácidos grasos de cadena corta, como el butirato, el propionato y el acetato, derivados de la fermentación de la fibra alimentaria.
Estas moléculas no solo nutren a las células del colon. También modulan la expresión génica. El butirato, por ejemplo, puede inhibir enzimas que compactan el ADN, facilitando la expresión de genes protectores relacionados con la reparación celular y el control de la inflamación. Es la fuente de energía principal para las células del colon, lo que permite regenerar la mucosa y fortalecer la barrera intestinal para evitar el paso de toxinas al torrente sanguíneo.
A nivel sistémico, este ácido graso de cadena corta actúa como un potente antiinflamatorio e inmunomodulador, ayudando a regular el sistema inmune, mejorar la sensibilidad a la insulina y proteger contra enfermedades metabólicas y ciertos tipos de cáncer, también actúa como un potente neuroprotector que mejora la comunicación en el eje intestino-cerebro, fortaleciendo la barrera hematoencefálica y ayudando a reducir la neuroinflamación asociada a enfermedades como el Alzheimer y el Parkinson. También estimula la producción de BDNF, una proteína esencial para la plasticidad neuronal y la memoria. Además, favorece un tránsito intestinal saludable al mejorar la motilidad, reduciendo síntomas como los gases y la hinchazón.
La analogía es clara: la microbiota actúa como una central química interna, transformando lo que comemos en señales biológicas que nuestras células interpretan. Si el sustrato es pobre y repetitivo, las señales también lo serán.
Cuando el equilibrio se rompe: disbiosis y ruido epigenético
No todas las microbiotas son iguales ni igualmente saludables. El término disbiosis describe un estado de desequilibrio en el que disminuye la diversidad bacteriana y proliferan especies menos beneficiosas o directamente perjudiciales.
Este desequilibrio no es inocuo. Se asocia con inflamación de bajo grado, alteraciones metabólicas, mayor permeabilidad intestinal y una señalización epigenética menos favorable. Es como vivir en una ciudad donde el ruido de fondo nunca cesa: al final, todo el sistema se resiente.
La evidencia relaciona la disbiosis con obesidad, síndrome metabólico, resistencia a la insulina, enfermedades inflamatorias intestinales, alergias y trastornos autoinmunes. No porque la microbiota “cause” estas patologías de forma aislada, sino porque modula el terreno biológico sobre el que se desarrollan.
Aquí conviene ser críticos: la microbiota no es una varita mágica. No sustituye a la genética, ni al contexto social, ni a otros factores fisiológicos. Pero sí es un factor amplificador. Puede inclinar la balanza hacia la adaptación o hacia el deterioro.
Microbiota e inmunidad: entrenar al sistema defensivo desde dentro
Aproximadamente el 70 % de las células del sistema inmunitario se localizan en el intestino. Esto no es casualidad. El sistema inmune necesita aprender a distinguir entre amenaza real y estímulo inofensivo, y la microbiota cumple una función pedagógica clave.
Una microbiota diversa y equilibrada favorece una respuesta inmunitaria eficiente pero contenida. En cambio, la disbiosis se asocia con respuestas exageradas o mal dirigidas, lo que explica su relación con alergias, intolerancias y enfermedades autoinmunes.
Desde el punto de vista epigenético, las señales microbianas influyen en la maduración de las células inmunitarias, condicionando qué genes se expresan durante su desarrollo. De nuevo, no se trata de encender o apagar un único interruptor, sino de afinar un sistema complejo.
La microbiota como primer filtro de compuestos tóxicos
La barrera intestinal funciona como un sistema inteligente de defensa: permite el paso de nutrientes esenciales y bloquea toxinas y microorganismos. Cuando esta barrera se altera, sustancias nocivas pueden atravesarla y generar inflamación y desequilibrios sistémicos.
La microbiota intestinal constituye el primer filtro. Algunas bacterias beneficiosas son capaces de descomponer compuestos tóxicos en formas menos reactivas o incluso inofensivas, reduciendo su impacto sobre el organismo. Es como si actuaran como pequeños técnicos especializados que identifican amenazas químicas y las desactivan antes de que alcancen las células intestinales. Cuando esta comunidad está equilibrada, la carga tóxica diaria se gestiona con mucha mayor eficacia.
La mucosa intestinal, el segundo filtro, actúa como una barrera física que separa el contenido intestinal de la pared del intestino. Cuando está íntegra, limita el paso de toxinas y sustancias irritantes; cuando se deteriora, aumenta la permeabilidad intestinal y permite que compuestos no deseados atraviesen esa barrera, sobrecargando al organismo.
El hígado funciona como el último gran filtro. Todo lo que logra pasar desde el intestino llega primero a él, donde las toxinas se transforman para poder ser eliminadas. Si la carga es excesiva, este sistema se satura y algunas sustancias permanecen más tiempo en circulación, afectando a otros tejidos sensibles.
Hormonas, metabolismo y microbiota: una conversación constante
La microbiota también participa en el metabolismo hormonal. Un ejemplo claro es el llamado estroboloma, el conjunto de bacterias implicadas en la metabolización de los estrógenos. Un desequilibrio en este sistema puede alterar la disponibilidad hormonal, con implicaciones en la salud reproductiva, el ciclo menstrual y ciertos riesgos metabólicos.
Además, la microbiota influye en la sensibilidad a la insulina, el almacenamiento de grasa y la regulación del apetito. No decide por sí sola cuánto peso ganamos o perdemos, pero sí condiciona cómo responde el organismo a la dieta y al ejercicio.
Por eso hay personas que, pese a seguir rutinas similares, obtienen resultados muy distintos. No es solo fuerza de voluntad ni genética pura: es también el estado del ecosistema interno.
Eje Intestino-Cerebro
La microbiota intestinal y el cerebro están conectados de forma bidireccional a través del eje intestino-cerebro, un sistema de comunicación que integra señales nerviosas (principalmente el nervio vago), hormonales e inmunológicas.
Las bacterias intestinales influyen en la producción de neurotransmisores y metabolitos que modulan el estado de ánimo, la respuesta al estrés y la función cognitiva, mientras que el cerebro, a través del sistema nervioso y el eje del estrés, puede alterar la composición y el comportamiento de la microbiota. Cuando este equilibrio se rompe, se favorecen procesos inflamatorios y alteraciones tanto digestivas como neurológicas y emocionales.
Y AQUÍ ENTRAN EN JUEGO EL EJERCICIO Y LOS BUENOS HÁBITOS:
El ejercicio regular favorece la motilidad intestinal, ayudando a un tránsito más eficiente y reduciendo la irritación de la mucosa. Además, disminuye la inflamación sistémica de bajo grado, un factor clave en el equilibrio de la microbiota. No es necesario entrenar de forma intensa: la constancia y el movimiento diario generan un entorno biológico más favorable para la diversidad bacteriana y una mejor comunicación metabólica.
El descanso adecuado también cumple una función reguladora fundamental. El intestino y su microbiota siguen ritmos circadianos que influyen en su actividad y composición. Dormir poco o de forma irregular desajusta estos ciclos, alterando la función microbiana y afectando a procesos como el metabolismo, la inmunidad y la regulación hormonal.
El estrés crónico, en cambio, actúa como un terremoto silencioso. A través del eje intestino-cerebro, aumenta la permeabilidad intestinal y modifica la composición de la microbiota, favoreciendo un estado inflamatorio persistente. Este desequilibrio no solo impacta en la salud digestiva, sino que amplifica alteraciones metabólicas e inmunológicas en todo el organismo.
Aquí la analogía es clara: no se puede construir una casa sólida en medio de sacudidas constantes.
Construir una microbiota que juegue a favor
Si aceptamos que la microbiota es moldeable, la pregunta lógica es cómo cuidarla sin caer en simplificaciones. No se trata de añadir probióticos de forma indiscriminada ni de perseguir una perfección imposible.
Una microbiota saludable se construye como una casa con buenos cimientos: variedad, constancia y contexto. La diversidad alimentaria, especialmente rica en fibra vegetal, proporciona el sustrato necesario para que diferentes especies bacterianas prosperen, además de alimentos fermentados como kéfir, yogurt, entre otros, que nos aportan otras bacterias vivas muy beneficiosas para nuestro organismo.
Aportan una fuente masiva de bacterias del género Lactobacillus y otras levaduras y probióticos, las cuales transforman la lactosa en ácido láctico, creando un ambiente ácido que impide el crecimiento de patógenos dañinos en el colon. Estos microorganismos actúan reforzando la barrera intestinal, lo que no solo optimiza la absorción de nutrientes y alivia problemas digestivos como la hinchazón o el estreñimiento, sino que también estimula el sistema inmunológico y reduce la inflamación sistémica.
Al equilibrar la microbiota, estas bacterias presentes en ambos lácteos fermentados contribuyen incluso a la salud metabólica y mental, facilitando una mejor digestión y una respuesta defensiva más eficiente ante infecciones.
Epigenética práctica: aplicar el conocimiento
Hablar de epigenética aplicada no significa “reprogramar tus genes”, una expresión más cercana al marketing que a la biología. Significa crear condiciones favorables para que los mecanismos de regulación funcionen de forma adaptativa.
La microbiota es una de esas condiciones. No controla el destino, pero sí el contexto. No dicta el texto, pero influye en cómo se lee. Y eso, a largo plazo, importa mucho.
Lo más relevante es entender que los cambios no son inmediatos ni lineales. El cuerpo no responde como una máquina, sino como un sistema vivo que necesita tiempo, coherencia y repetición.
Conclusión: cuidar tu segundo genoma para expresar mejor el primero
La microbiota intestinal no es un actor secundario, pero tampoco un protagonista absoluto. Es un mediador clave entre el entorno y nuestros genes, capaz de influir en la inflamación, la inmunidad, el metabolismo y la expresión epigenética.
Cuidarla no garantiza salud perfecta, pero ignorarla aumenta el riesgo de desequilibrio. En un mundo donde no siempre podemos controlar la genética ni el entorno, sí podemos intervenir en cómo vivimos, comemos, descansamos y gestionamos el estrés.
En ese margen de acción cotidiana se construye, día a día, nuestro segundo genoma. Y con él, la forma en que el primero se expresa. No como una promesa milagrosa, sino como una oportunidad real y biológicamente coherente de inclinar la balanza hacia la salud.
Referencias bibliográficas
- Carvajal, A. (2005). Estrés y depresión: una mirada desde la clínica a la neurobiología. Revista Médica Clínica Las condes, 16(4).
- Quitto Navarrete , V. P. ., Tayupanda Cuvi , N. J., Girón Saltos , K. Y., & Hidalgo Morales , K. P. (2024). Alteración del ciclo sueño/vigilia y su asociación con la resistencia a la insulina: una revisión sistemática . Revista Científica De Salud BIOSANA, 4(1), 73–86. https://doi.org/10.62305/biosana.v4i1.82
- Qureshi, I. A., & Mehler, M. F. (2014). Epigenetics of sleep and chronobiology. Current neurology and neuroscience reports, 14(3), 432. https://doi.org/10.1007/s11910-013-0432-6
- St-Onge, M. P., Mikic, A., & Pietrolungo, C. E. (2016). Effects of Diet on Sleep Quality. Advances in nutrition (Bethesda, Md.), 7(5), 938–949. https://doi.org/10.3945/an.116.012336




Leave A Comment